Pajęcze nici superwytrzymałe
Pajęcze nici są zbudowane z białek wytrzymałych na rozciąganie. Przegląd kilkudziesięciu tysięcy struktur białkowych, przeprowadzony za pomocą symulacji komputerowych w Instytucie Fizyki PAN w Warszawie, ujawnił, że pająki wcale nie stosują budulca o najlepszych parametrach mechanicznych. Naukowcy znaleźli białko dwukrotnie bardziej wytrzymałe od pajęczej nici.
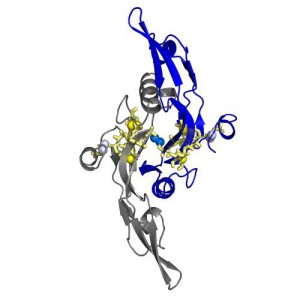
Białko 1TFG o rekordowej wytrzymałości na rozciąganie mechaniczne. Grafika odseparowana od tła. (Źródło: IF PAN)
Trudno ulepszyć superbohatera. Jednak Spiderman z pewnością zainteresowałby się odkryciem naukowców z Instytutu Fizyki Polskiej Akademii Nauk w Warszawie. Dzięki rozwijanej tu od lat teorii i szybkim algorytmom modelującym zachowanie białka udało się przeprowadzić symulacje mechanicznego rozciągania dużej liczby struktur białkowych. Wyniki przeglądu przyniosły spore zaskoczenie.

Po lewej białko 1TFG o rekordowej wytrzymałości na rozciąganie mechaniczne, z oczkiem spiętym mostkami dwusiarczkowymi i przetkniętą przez nie końcówkę łańcucha aminokwasowego z pętlą. Po prawej białko 2B1Y, rekordzista bez mostków dwusiarczkowych. U dołu schematy budowy obu białek. (Źródło: IF PAN)
Obecny przegląd, już drugi przeprowadzony przez naszą grupę, objął 18 tysięcy białek z największej bazy danych – Protein Data Bank. Spodziewaliśmy się znaleźć wśród nich struktury bijące dotychczasowe rekordy wytrzymałości na rozciąganie. Nie sądziliśmy jednak, że tak wyśrubujemy rekord”, mówi prof. dr hab. Marek Cieplak, który w IF PAN kieruje zespołem zajmującym się badaniem mechanostabilności białek.
Białka są wytwarzane przez rybosomy jako długie, proste łańcuchy aminokwasów. Po wyprodukowaniu, w odpowiednich warunkach każdy łańcuch zwija się w kłębek. W ten sposób tworzy się struktura natywna, o kształcie charakterystycznym dla konkretnego białka.
Współczesne narzędzia laboratoryjne pozwalają chwytać pojedyncze cząsteczki białka za swobodne końce łańcuchów i poddawać je mechanicznemu rozciąganiu. Operacje te są przeprowadzane za pomocą mikroskopów sił atomowych lub tzw. szczypiec optycznych. Doświadczenia wymagają jednak dużej staranności i są czasochłonne, na dodatek niewiele laboratoriów potrafi je przeprowadzać. W rezultacie do tej pory na świecie przebadano tak zaledwie ok. 100 białek
My nie przeprowadzamy doświadczeń z rozciąganiem białek. Robimy symulacje komputerowe, które korzystają z naszego własnego modelu teoretycznego, rozwijanego już od kilkunastu lat. Jest uproszczony, empiryczny, ale przez to symulacje są bardzo szybkie. Zbadanie procesu rozciągania jednego białka za pomocą dokładnych modeli zajmuje nawet pół roku. My już po 20 minutach dostajemy wyniki, które dobrze się zgadzają z pomiarami w laboratoriach”, wyjaśnia prof. Cieplak.
Rozerwanie nici DNA – jej „rozpięcie” niczym zamka błyskawicznego – wymaga niewielkiej siły, w każdym momencie pęka bowiem tylko jedno słabe wiązanie wodorowe. Wystarczy do tego siła zaledwie 15 pikoniutonów (1 pN to jedna tysięczna jednej miliardowej niutona). W przypadku białek za wytrzymałe uznaje się struktury zrywające się przy siłach powyżej 200 pN. Wśród białek zbadanych doświadczalnie dotychczasowy rekordzista wytrzymywał 500 pN.
Efektem naszych symulacji są wykresy obrazujące zależność przyłożonej siły od przesunięcia uchwytu rozciągającego białko. Na jednym z takich wykresów zauważyliśmy wyjątkowo mocne maksimum siły. Początkowo sądziliśmy, że jest to jakiś artefakt. Dopiero z czasem uświadomiliśmy sobie, że to nie artefakt, a odkrycie”, wspomina doktorant Mateusz Sikora z IF PAN.
Znalezione białko, znane jako 1TFG, wytrzymuje siłę aż 1500 pN, dwukrotnie większą od tej, która zrywa struktury pajęczej nici.
Rekordowa wytrzymałość wynika ze specyficznej budowy zwiniętego białka. Gdy prosty łańcuch białka 1TFG zwija się formując strukturę natywną, w pewnym miejscu między biegnącymi równolegle do siebie fragmentami łańcucha tworzą się dwa silne wiązania kowalencyjne – mostki dwusiarczkowe. „To tak, jakbyśmy wzięli linę, złożyli ją na pół i w dwóch miejscach ją zszyli. Między miejscami zszycia powstanie wtedy coś w rodzaju oczka”, opisuje mgr Sikora.
Kluczowy jest fakt, że w białku 1TFG przez oczko uformowane ze spiętych części łańcucha przechodzi mostek dwusiarczkowy, który tworzy się między dwoma innymi fragmentami białka. „Mamy więc zbudowane z kilku aminokwasów oczko, przez które jest przewleczony mostek. W przypadku białka 1TFG jest jednak dodatkowa atrakcja: po jednej stronie oczka, za mostkiem, mamy sporą pętlę. Jeśli teraz przyłożymy siłę rozciągającą do odpowiednich końcówek białka, stajemy przed trudnym zadaniem: musimy przepchnąć dużą pętlę przez mniejsze od niej oczko. To udaje się dopiero wtedy, gdy działająca siła jest tak duża, że ściśnie pętlę”, wyjaśnia Sikora.
Parametry mechaniczne znalezionego białka zostaną w przyszłości zweryfikowane w ośrodkach doświadczalnych współpracujących z grupą z IF PAN. Jeśli zostaną potwierdzone, otwiera się droga do wielu zastosowań. Polimery z białka 1TFG prawdopodobnie świetnie nadawałyby się na opatrunki lub nici chirurgiczne. Mogłyby być również stosowane jako efektywne absorbery energii mechanicznej lub elementy czynne mechanosensorów. „Zawsze pozostaje też możliwość udoskonalenia Spidermana. Gdyby był zainteresowany współpracą, wie, gdzie nas szukać”, mówi ze śmiechem prof. Cieplak.
W najnowszym przeglądzie białek fizykom z IF PAN udało się znaleźć jeszcze kilkanaście innych struktur o wytrzymałości na rozciąganie dochodzącej do 1000 pN. Jedno z nich, znane jako 2B1Y, wyróżniało się kształtem: dwa łańcuchy białkowe były ułożone po prostu wzdłuż siebie i połączone wiązaniami wodorowymi, bez mostków dwusiarczkowych. Duża odporność na rozciąganie wynikała tu z faktu, że oba łańcuchy białkowe były wokół siebie skręcone. Struktury tego typu nie da się zniszczyć jak DNA, wiązanie wodorowe po wiązaniu – trzeba zerwać je wszystkie jednocześnie.
Praca opisująca odkrycie naukowców z IF PAN ukazała się 8 listopada 2012 r. w prestiżowym czasopiśmie fizycznym „Physical Review Letters”.






Zaloguj się Logowanie